ในการที่จะให้นิยามของกรด- เบส และในการจำแนกสารต่างๆ ว่าเป็นกรดหรือเบสนั้นได้มีนักวิทยาศาสตร์ ได้ศึกษาและตั้งทฤษฎีกรด- เบส ขึ้นหลายทฤษฎีด้วยกัน ทฤษฎีกรด- เบสที่สำคัญมีดังนี้
ทฤษฎีกรด- เบสของอาร์เรเนียส
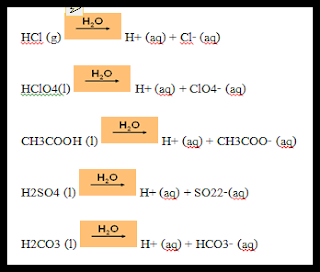
อาร์เรเนียส เป็นนักวิทยาศาสตร์ชาวสวีเดน ได้ตั้งทฤษฎีกรด- เบส ในปี ค. ศ. 1887 ( พ. ศ. 2430) อาร์เรเนียสศึกษาสารที่ละลายน้ำ (Aqueous solution) และการนำไฟฟ้าของสารละลายนั้น เขาพบว่าสารอิเล็กโทรไลต์จะแตกตัวเป็นไอออน เมื่อละลายอยู่ในน้ำและให้นิยามกรดไว้ว่า
“ กรด คือ สารที่เมื่อละลายน้ำแล้วแตกตัวให้ไฮโดรเจนไอออน” เช่น
“ เบส คือ สารที่เมื่อละลายน้ำแล้วแตกตัวให้ไฮดรอกไซด์ไอออน” เช่น
ทฤษฎีกรด- เบส อาร์เรเนียส จะเน้นเฉพาะการแตกตัวในน้ำ ให้เป็น H+และ OH- ไม่รวมถึงตัวทำละลายอื่นๆ ทำให้อธิบายความเป็นกรด- เบสได้จำกัด
สารที่ี่จะเป็นกรดได้ต้องมี H+ อยู่ในโมเลกุล และสารที่ี่จะเป็นเบสได้ก็ต้องมี OH- อยู่ในโมเลกุล
โจฮันส์ นิโคลัส เบรินสเตต นักเคมีชาวเดนมาร์ก และ โทมัส มาร์ติน ลาวรี นักเคมีชาวอังกฤษ ได้ศึกษาการให้และรับโปรตอนของสาร เพื่อใช้ในการอธิบายและจำแนกกรด- เบสได้กว้างขึ้น และได้ตั้งทฤษฎีกรด- เบสขึ้นในปี ค. ศ.1923 ( พ. ศ.2466)
กรด คือ สารที่ี่สามารถให้โปรตอนกับสารอื่นๆ ได้ (Proton donor)
เบส คือ สารที่ี่สามารถรับโปรตอนจากสารอื่นได้ (Proton acceptor)
พิจารณาตัวอย่างต่อไปนี้
1.
HCl เป็นสารที่ี่ให้โปรตอน (H+) ดังนั้น HCl จึงเป็นกรด
H2O เป็นสารที่ี่รับโปรตอน (H+) ดังนั้น H2Oจึงเป็นเบส
H2O เป็นสารที่ี่รับโปรตอน (H+) ดังนั้น H2Oจึงเป็นเบส
2.
NH4+ เป็นสารที่ี่ให้โปรตอน (H+) ดังนั้น NH4+จึงเป็นกรด
H2Oเป็นสารที่ี่รับโปรตอน (H+) ดังนั้น H2Oจึงเป็นเบส
H2Oเป็นสารที่ี่รับโปรตอน (H+) ดังนั้น H2Oจึงเป็นเบส
3.
H2Oเป็นสารที่ี่ให้โปรตอน (H+) ดังนั้น H2Oจึงเป็นกรด
NH3เป็นสารที่ี่รับโปรตอน (H+) ดังนั้น NH3 จึงเป็นเบส
จากปฏิกิริยาทั้ง 3 ปฏิกิริยา จะมีสารที่ี่ให้และรับโปรตอนในแต่ละปฏิกิริยา และมี H3O+ และ OH-เกิดขึ้น
NH3เป็นสารที่ี่รับโปรตอน (H+) ดังนั้น NH3 จึงเป็นเบส
จากปฏิกิริยาทั้ง 3 ปฏิกิริยา จะมีสารที่ี่ให้และรับโปรตอนในแต่ละปฏิกิริยา และมี H3O+ และ OH-เกิดขึ้น
ทฤษฎีกรด- เบสของเบรินสเตต- ลาวรี ใช้อธิบายสมบัติของกรด- เบส ได้กว้างกว่าทฤษฎีของอาร์เรเนียส แต่ยังมีข้อจำกัดคือ สารที่จะทำหน้าที่เป็นกรดจะต้องมีโปรตอนอยู่ในสารนั้น
สารบางตัวทำหน้าที่เป็นทั้งกรด เมื่อทำปฏิกิริยากับสารตัวหนึ่ง และทำหน้าที่เป็นเบส เมื่อทำปฏิกิริยากับอีกสารหนึ่ง นั่นคือเป็นได้ทั้งกรดและเบส สารที่มีลักษณะนี้เรียกว่า สารเอมโพเทอริก(Amphoteric) เช่น H2O , HCO3- เป็นต้น
กรณีของ H2O
ในกรณีนี้ H2O เป็นกรดเมื่อทำปฏิกิริยากับ NH3 และเป็นเบสเมื่อทำปฏิกิริยากับNH4+
กรณีของ HCO3-
ในกรณีนี้ HCO3- เป็นเบสเมื่อทำปฏิกิริยากับ HCl และเป็นกรดเมื่อทำปฏิกิริยากับ OH-
ดังนั้น อาจจะสรุปได้ว่า สารที่เป็นเอมโฟเทอริก ถ้าทำปฏิกิริยากับสารที่ให้โปรตอนได้ดีกว่า ตัวมันเองจะรับโปรตอน ( ทำหน้าที่เป็นเบส) แต่ถ้าไปทำปฏิกิริยากับสารที่ให้โปรตอนได้ไม่ดี ตัวมันเองจะเป็นตัวให้โปรตอนกับสารนั้น ( ทำหน้าเป็นกรด)
ในปี ค. ศ. 1923 ( พ. ศ. 2466) ลิวอีสไดเสนอนิยามของกรดและเบสดังนี้
กรด คือ สารที่สามารถรับอิเล็กตรอนคู่ จากเบส แล้วเกิดพันธะโคเวเลนต์
เบส คือ สารที่สามารถให้อิเล็กตรอนคู่ในการเกิดพันธะโคเวเลนต์
ปฏิกิริยาระหว่างกรด- เบส ตามทฤษฎีนี้ อธิบายในเทอมที่มีการใช้อิเล็กตรอนคู่ร่วมกัน กรดรับอิเล็กตรอนเรียกว่าเป็น Electrophile และเบสให้อิเล็กตรอนเรียกว่าเป็น Nucleophile และตามทฤษฎีนี้สารที่เป็นเบสต้องมีอิเล็กตรอนคู่อิสระ เช่น
ในกรณีนี้ NH3 เป็นเบส มีอิเล็กตรอนคู่ 1 คู่ จะให้อิเล็กตรอนคู่กับกรดในการเกิดพันธะโคเวเลนต์ และ BF3รับอิเล็กตรอนจาก NH3BF3 จึงเป็นกรด
ทฤษฎีของลิวอิสนี้มีข้อดีคือ สามารถจำแนกกรด- เบส ที่ไม่มีทั้ง H หรือ OH- ในสารนั้น และแม้ว่าสารนั้นไม่ได้อยู่ในรูปสารละลาย แต่อยู่ในสถานะแก๊สก็สามารถใช้ทฤษฎีลิวอิสอธิบายความเป็นกรดเบสได้
ตัวอย่างอื่นๆ เช่น
ตัวอย่างที่ 4 ปฏิกิริยาต่อไปนี้ สารตั้งต้นใดทำหน้าที่เป็นกรด สารใดทำหน้าที่เป็นเบสตามทฤษฎีของอาร์เรเนียส
วิธีทำ
ก. HSO4- (aq) + H2O (l) SO4 2- + H3O+
HSO4- ให้ H+ ในน้ำ HSO4-- ทำหน้าที่เป็นกรด
ข. LiOH (s) เป็นเบสเพราะ แตกตัวให้ OH- ในน้ำ
ค. H2Oเป็นทั้งกรดและเบส โมเลกุลหนึ่งให้ H3O+ ( เป็นกรด) อีกโมเลกุลหนึ่งแตกตัวให้ OH- ( เป็นเบส)
ตัวอย่างที่ 5 ในปฏิกิริยาต่อไปนี้ HCO3- ไอออนทำหน้าที่เป็นกรดในปฏิกิริยาใด
วิธีทำ
ก. HCO3- (aq) ไม่ใช่กรด แต่เป็นเบสเพราะรับ H+
ข. HCO3- (aq) เป็นกรด เพราะให้ H+ กับ OH-
ค. HCO3- (aq) เป็นเบส เพราะรับ H+
ง. HCO3- (aq) เป็นเบส เพราะรับH+จาก CH3COOH (aq) ได้ H2O (l) + CO2(g)
ตัวอย่างที่ 6 สารต่อไปนี้ ข้อใดทำหน้าที่ได้ทั้งกรดและเบส
ก. HC2O4 2-
ข. CO3 2-
ค. CN -
ง. HSO4 -
เฉลย
ข้อ ก และ ง เป็นได้ทั้งกรดและเบส เพราะสามารถให้ และรับ H+ ได้
ข้อ ข และ ค. เป็นเบสได้เพียงอย่างเดียว เพราะให้โปรตอนไม่ได้เนื่องจากไม่มี H แต่สามารถรับโปรตอนได้ กลายเป็น HCO3- และ HCN ตามลำดับ