ในการที่จะให้นิยามของกรด- เบส และในการจำแนกสารต่างๆ ว่าเป็นกรดหรือเบสนั้นได้มีนักวิทยาศาสตร์ ได้ศึกษาและตั้งทฤษฎีกรด- เบส ขึ้นหลายทฤษฎีด้วยกัน ทฤษฎีกรด- เบสที่สำคัญมีดังนี้
ทฤษฎีกรด- เบสของอาร์เรเนียส
อาร์เรเนียส เป็นนักวิทยาศาสตร์ชาวสวีเดน ได้ตั้งทฤษฎีกรด- เบส ในปี ค. ศ. 1887 ( พ. ศ. 2430) อาร์เรเนียสศึกษาสารที่ละลายน้ำ (Aqueous solution) และการนำไฟฟ้าของสารละลายนั้น เขาพบว่าสารอิเล็กโทรไลต์จะแตกตัวเป็นไอออน เมื่อละลายอยู่ในน้ำและให้นิยามกรดไว้ว่า
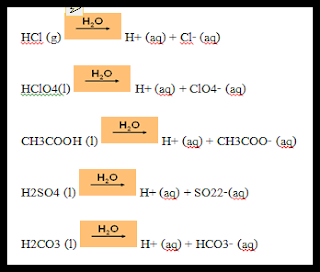
“ กรด คือ สารที่เมื่อละลายน้ำแล้วแตกตัวให้ไฮโดรเจนไอออน” เช่น
“ เบส คือ สารที่เมื่อละลายน้ำแล้วแตกตัวให้ไฮดรอกไซด์ไอออน” เช่น
ทฤษฎีกรด- เบส อาร์เรเนียส จะเน้นเฉพาะการแตกตัวในน้ำ ให้เป็น H+และ OH- ไม่รวมถึงตัวทำละลายอื่นๆ ทำให้อธิบายความเป็นกรด- เบสได้จำกัด
สารที่ี่จะเป็นกรดได้ต้องมี H+ อยู่ในโมเลกุล และสารที่ี่จะเป็นเบสได้ก็ต้องมี OH- อยู่ในโมเลกุล
โจฮันส์ นิโคลัส เบรินสเตต นักเคมีชาวเดนมาร์ก และ โทมัส มาร์ติน ลาวรี นักเคมีชาวอังกฤษ ได้ศึกษาการให้และรับโปรตอนของสาร เพื่อใช้ในการอธิบายและจำแนกกรด- เบสได้กว้างขึ้น และได้ตั้งทฤษฎีกรด- เบสขึ้นในปี ค. ศ.1923 ( พ. ศ.2466)
กรด คือ สารที่ี่สามารถให้โปรตอนกับสารอื่นๆ ได้ (Proton donor)
เบส คือ สารที่ี่สามารถรับโปรตอนจากสารอื่นได้ (Proton acceptor)
พิจารณาตัวอย่างต่อไปนี้
1.
HCl เป็นสารที่ี่ให้โปรตอน (H+) ดังนั้น HCl จึงเป็นกรด
H2O เป็นสารที่ี่รับโปรตอน (H+) ดังนั้น H2Oจึงเป็นเบส
H2O เป็นสารที่ี่รับโปรตอน (H+) ดังนั้น H2Oจึงเป็นเบส
2.
NH4+ เป็นสารที่ี่ให้โปรตอน (H+) ดังนั้น NH4+จึงเป็นกรด
H2Oเป็นสารที่ี่รับโปรตอน (H+) ดังนั้น H2Oจึงเป็นเบส
H2Oเป็นสารที่ี่รับโปรตอน (H+) ดังนั้น H2Oจึงเป็นเบส
3.
H2Oเป็นสารที่ี่ให้โปรตอน (H+) ดังนั้น H2Oจึงเป็นกรด
NH3เป็นสารที่ี่รับโปรตอน (H+) ดังนั้น NH3 จึงเป็นเบส
จากปฏิกิริยาทั้ง 3 ปฏิกิริยา จะมีสารที่ี่ให้และรับโปรตอนในแต่ละปฏิกิริยา และมี H3O+ และ OH-เกิดขึ้น
NH3เป็นสารที่ี่รับโปรตอน (H+) ดังนั้น NH3 จึงเป็นเบส
จากปฏิกิริยาทั้ง 3 ปฏิกิริยา จะมีสารที่ี่ให้และรับโปรตอนในแต่ละปฏิกิริยา และมี H3O+ และ OH-เกิดขึ้น
ทฤษฎีกรด- เบสของเบรินสเตต- ลาวรี ใช้อธิบายสมบัติของกรด- เบส ได้กว้างกว่าทฤษฎีของอาร์เรเนียส แต่ยังมีข้อจำกัดคือ สารที่จะทำหน้าที่เป็นกรดจะต้องมีโปรตอนอยู่ในสารนั้น
สารบางตัวทำหน้าที่เป็นทั้งกรด เมื่อทำปฏิกิริยากับสารตัวหนึ่ง และทำหน้าที่เป็นเบส เมื่อทำปฏิกิริยากับอีกสารหนึ่ง นั่นคือเป็นได้ทั้งกรดและเบส สารที่มีลักษณะนี้เรียกว่า สารเอมโพเทอริก(Amphoteric) เช่น H2O , HCO3- เป็นต้น
กรณีของ H2O
ในกรณีนี้ H2O เป็นกรดเมื่อทำปฏิกิริยากับ NH3 และเป็นเบสเมื่อทำปฏิกิริยากับNH4+
กรณีของ HCO3-
ในกรณีนี้ HCO3- เป็นเบสเมื่อทำปฏิกิริยากับ HCl และเป็นกรดเมื่อทำปฏิกิริยากับ OH-
ดังนั้น อาจจะสรุปได้ว่า สารที่เป็นเอมโฟเทอริก ถ้าทำปฏิกิริยากับสารที่ให้โปรตอนได้ดีกว่า ตัวมันเองจะรับโปรตอน ( ทำหน้าที่เป็นเบส) แต่ถ้าไปทำปฏิกิริยากับสารที่ให้โปรตอนได้ไม่ดี ตัวมันเองจะเป็นตัวให้โปรตอนกับสารนั้น ( ทำหน้าเป็นกรด)
ในปี ค. ศ. 1923 ( พ. ศ. 2466) ลิวอีสไดเสนอนิยามของกรดและเบสดังนี้
กรด คือ สารที่สามารถรับอิเล็กตรอนคู่ จากเบส แล้วเกิดพันธะโคเวเลนต์
เบส คือ สารที่สามารถให้อิเล็กตรอนคู่ในการเกิดพันธะโคเวเลนต์
ปฏิกิริยาระหว่างกรด- เบส ตามทฤษฎีนี้ อธิบายในเทอมที่มีการใช้อิเล็กตรอนคู่ร่วมกัน กรดรับอิเล็กตรอนเรียกว่าเป็น Electrophile และเบสให้อิเล็กตรอนเรียกว่าเป็น Nucleophile และตามทฤษฎีนี้สารที่เป็นเบสต้องมีอิเล็กตรอนคู่อิสระ เช่น
ในกรณีนี้ NH3 เป็นเบส มีอิเล็กตรอนคู่ 1 คู่ จะให้อิเล็กตรอนคู่กับกรดในการเกิดพันธะโคเวเลนต์ และ BF3รับอิเล็กตรอนจาก NH3BF3 จึงเป็นกรด
ทฤษฎีของลิวอิสนี้มีข้อดีคือ สามารถจำแนกกรด- เบส ที่ไม่มีทั้ง H หรือ OH- ในสารนั้น และแม้ว่าสารนั้นไม่ได้อยู่ในรูปสารละลาย แต่อยู่ในสถานะแก๊สก็สามารถใช้ทฤษฎีลิวอิสอธิบายความเป็นกรดเบสได้
ตัวอย่างอื่นๆ เช่น
ตัวอย่างที่ 4 ปฏิกิริยาต่อไปนี้ สารตั้งต้นใดทำหน้าที่เป็นกรด สารใดทำหน้าที่เป็นเบสตามทฤษฎีของอาร์เรเนียส
วิธีทำ
ก. HSO4- (aq) + H2O (l) SO4 2- + H3O+
HSO4- ให้ H+ ในน้ำ HSO4-- ทำหน้าที่เป็นกรด
ข. LiOH (s) เป็นเบสเพราะ แตกตัวให้ OH- ในน้ำ
ค. H2Oเป็นทั้งกรดและเบส โมเลกุลหนึ่งให้ H3O+ ( เป็นกรด) อีกโมเลกุลหนึ่งแตกตัวให้ OH- ( เป็นเบส)
ตัวอย่างที่ 5 ในปฏิกิริยาต่อไปนี้ HCO3- ไอออนทำหน้าที่เป็นกรดในปฏิกิริยาใด
วิธีทำ
ก. HCO3- (aq) ไม่ใช่กรด แต่เป็นเบสเพราะรับ H+
ข. HCO3- (aq) เป็นกรด เพราะให้ H+ กับ OH-
ค. HCO3- (aq) เป็นเบส เพราะรับ H+
ง. HCO3- (aq) เป็นเบส เพราะรับH+จาก CH3COOH (aq) ได้ H2O (l) + CO2(g)
ตัวอย่างที่ 6 สารต่อไปนี้ ข้อใดทำหน้าที่ได้ทั้งกรดและเบส
ก. HC2O4 2-
ข. CO3 2-
ค. CN -
ง. HSO4 -
เฉลย
ข้อ ก และ ง เป็นได้ทั้งกรดและเบส เพราะสามารถให้ และรับ H+ ได้
ข้อ ข และ ค. เป็นเบสได้เพียงอย่างเดียว เพราะให้โปรตอนไม่ได้เนื่องจากไม่มี H แต่สามารถรับโปรตอนได้ กลายเป็น HCO3- และ HCN ตามลำดับ











Titanium Brushed Stainless Steel Brushed Stainless Steel Brushed
ตอบลบTitanium Brushed infiniti pro rainbow titanium flat iron Stainless Steel head titanium tennis racket Brushed titanium screws Stainless Steel Brushed Stainless Steel smith titanium Brushed Stainless Steel Brushed Stainless Steel Brushed Stainless Steel Brushed Stainless Steel Brushed Stainless Steel $33.96 · used ford edge titanium In stock